(圖/衛福部疾管署YouTube)
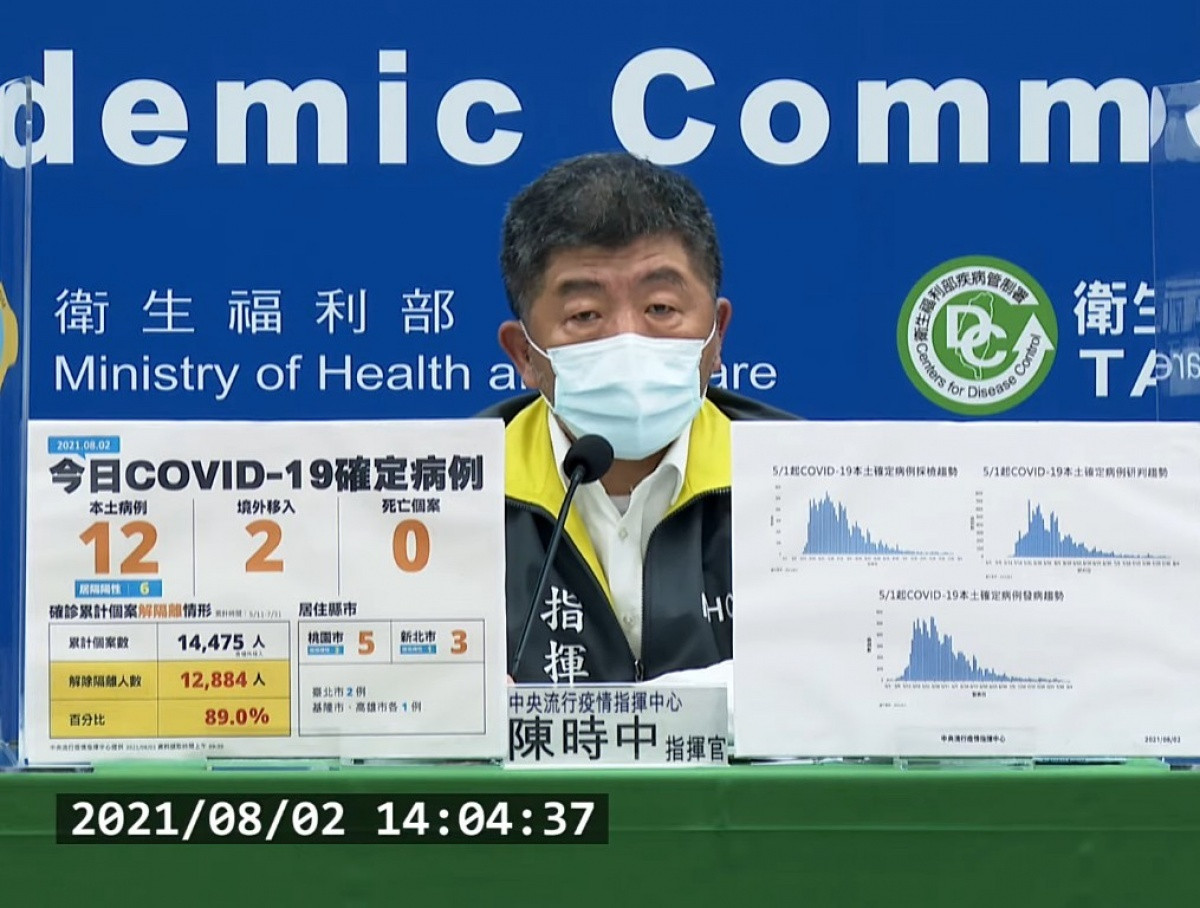
國產高端新冠肺炎疫苗早在EUA通過前就已開始量產,還提前送食藥署檢驗,被外界質疑「偷跑」。對此,指揮官陳時中2日解釋,若等到EUA通過才開始量產、送驗,恐怕得再等半年,才能上市。為加速行政流,EUA前會要求先把產品做出來,要求實驗平行進行,每個階段做到2/3就開始同步進行下一階段,若失敗則由政府吸收損失,才能加速研發疫苗。
食藥署2日宣布,首4批高端新冠肺炎疫苗,共26萬5528劑,已完成審查與檢驗,並核發封緘證明書,進行最後倉儲檢驗封緘作業,預計貼完標籤後即可配送,進行後續疫苗接種作業。但外界質疑,高端疫苗在還未通過EUA時就已開始量產,還提前送食藥署檢驗。
對此,陳時中表示,為了加速EUA進行,各國都簡化行政流程。如果「還停留在過去方式」,等EUA審查過後才量產,等到實際有疫苗可用恐怕得再等半年,也就失去公衛緊急效益。
政府要求廠商在EUA通過之前就先開始量產,陳時中說,為了加速EUA,讓疫苗盡快上市,實驗到一定程度後,提前開始進行下一步、再開始下一步,廠商有的願意,有的不願意,不願意的原因就是財務風險太高,「實驗沒有保證會成功的!」
陳時中進一步說,政府要求廠商實驗平行進行,加快研發速度,A階段進行到2/3就開始做B,若失敗則由政府吸收損失,等同投資疫苗研發並幫忙分攤財務風險。
陳時中強調,「做蛋糕都可能失敗了」,何況疫苗高科技的產品也不是像做蛋糕一樣快速。疫苗要使用在民眾身上,數值稍微有誤差,審查就不會過。必須要過兩關,一是取得EUA或查驗登記,二是通過食藥署檢驗封緘。萬一EUA沒過,政府協助負擔材料費。